5 минут с ... Андреем Кардашевым, Руководителем рабочей проектной группы по внедрению системы сериализации и агрегации на ПАО «Фармак»

– Андрей, что привело Вас на Innovation Serialisation Summit, организованный компанией Adents?
В соответствии с требованиями Директивы 2011/62/EU Еврокомиссии о защите от подделки лекарств (FMD) многие производители работают над внедрением систем сериализации, а на некоторых фармпредприятиях – над модернизацией поставленного ранее технологического оборудования.
В динамической и изменчивой конкурентной среде внедрение системы сериализации и агрегации предусматривает большой перечень необходимых изменений в технологиях и процессах компаний-производителей лекарственных средств, что способствует их уверенному присутствию на мировых рынках.
В связи с необходимостью внедрения системы сериализации на нашем предприятии возник ряд организационных и технических вопросов. Саммит, организованный компанией Adents в Париже 5 – 6 апреля 2018 г., позволил получить ответы на некоторые из них.
– Какие сложности возникают у Вас как у руководителя рабочей проектной группы по внедрению системы сериализации и агрегации на предприятии?
Я разделяю все возникающие вопросы в системе сериализации на организационные и технические. Организационные вопросы связаны с процессом передачи украинским фармпредприятием всей необходимой информации о произведенной и прошедшей проверку продукции (masterdata) в европейский регуляторный орган. Какие усилия следует предпринять, чтобы предприятие оказалось на европейском рынке? Необходимо ли физическое присутствие компании- производителя на территории Европы? Каким кадровым ресурсом должна обладать компания для организации, настройки и конфигурирования каналов передачи данных для регуляторного органа?
По стандарту ANSI / ISA-95 в зависимости от функциональных составляющих систему сериализации и агрегации разделяют на пять уровней (рисунок).
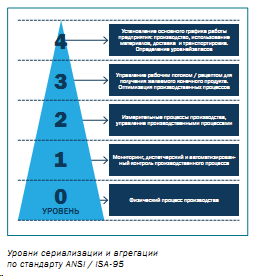
Для реализации лекарственных средств на территории стран ЕС необходимо организовать процесс передачи (уведомления) информации о произведенной лекарственной сериализованной продукции в European Medicines Verification Organization (EMVO). Эта организация отвечает за создание и обеспечение функционирования европейской системы верификации лекарственных средств. Ее частью является EU HUB – точка входа данных сериализации, сгенерированных владельцами регистрационного досье с последующим распределением (маршрутизацией) в соответствующие национальные системы верификации.
Украинские фармпредприятия, которые продают лекарственные средства на территории Европейского Союза, должны иметь своего представителя, так называемого OBP (On-Boarding Partner), который заключает соглашение с EMVO и получает возможность подключения к EU HUB. В качестве OBP может выступать собственник регистрации или, в случае группы компаний с несколькими владельцами регистрации, одна из компаний-филиалов, которая будет представлять интересы всех собственников регистрации в группе компаний и отвечать за передачу данных сериализации. OBP может также выступать в рамках данной структуры как МАН (Marketing Authorization Holder) – владелец разрешения на торговлю лекарственными средствами. С учетом вышеизложенного многие фармпредприятия Украины могут выступать, в части передачи информации о произведенной и сериализованной продукции, только как контрактный производитель – СМО (Contract Мanufacturing Оrganization).
– Как саммит, организованный компанией Adents, помог получить ответы на Ваши вопросы?
Компания Adents подготовила полезное многоплановое информационное мероприятие, на которое были приглашены представители таких ведущих компаний и организаций, как Microsoft, Siemens, GS1, Medicines for Europe, Zelros, Epista Life Science, Healthcare Distribution Alliance и др.
Сериализация фармацевтической продукции для европейского рынка станет обязательной с 9 февраля 2019 г. И только 45 % компаний-производителей лекарственных средств успевают в срок организовать на своем производстве все необходимые мероприятия.
С учетом сжатых сроков преимущество в реализации системы сериализации / агрегации получат компании-интеграторы, которые могут предоставить комплексное модульное решение от уровня 2 до уровня 5. Анализируя рынок предложений этих решений, мы увидели, что таких компаний немного. Предоставляемые ими решения для производителей лекарственных средств построены на аппаратно-программных комплексах различных поставщиков. Одной из таких компаний-интеграторов является Adents, которая для уровня 2 использует решение Adents Seriza на базе аппаратного обеспечения компании Siemens, что позволяет производителям лекарственных средств иметь унифицированную линейку оборудования на нижнем уровне для реализации задач управления технологическим и инженерным оборудованием. Решение Adents Prodigi (совместная разработка с Microsoft) позволяет решить функциональные задачи уровней 3 – 4 по стандарту ANSI / ISA-95, а именно: генерация серийных номеров, передача их на уровень оборудования для сериализации / агрегации, а также хранение и передача серийных номеров на верхний уровень – уровень регуляторного органа.
Актуальным и интересным, с точки зрения унифицированности и доступности использования сериализационных данных на уровнях 3 – 4, является решение Adents Seriza, которое предусматривает облачное хранение данных, что позволяет существенно сократить использование физического аппаратного обеспечения системы и не применять дополнительный ресурс для установки, настройки (конфигурации) и обслуживания системы. Но в таком случае возникает другой вопрос – соответствует ли облачное решение действующим руководящим принципам Надлежащей производственной практики (GMP), поскольку вследствие использования критичных данных для производства лекарственных средств необходимо всегда знать их физическое местонахождение.
– Сколько компаний-поставщиков решений для уровней 3 – 4 системы сериализации / агрегации, использующих облачное хранение данных, позволяют обеспечить соответствие облачных решений руководящим принципам сGMP?
Многие системные интеграторы используют решения на базе облачного хранения от таких компаний, как, например, Amazon Web Services и Microsoft Azure.
Microsoft совместно с компанией Adents на базе платформы Adents Seriza реализовала создание, надежное хранение, обмен, управление и анализ данных сериализации путем использования технологии Microsoft Azure. Azure позволяет осуществить сбор данных и контролируемый доступ, безопасное хранение и обмен данными с заинтересованными сторонами процесса сериализации / агрегации. Следует отметить, что Microsoft – одна из немногих компаний, разработавших методические руководства по вопросу соответствия облачного решения нормативным требованиям для определения общих обязанностей между компанией Microsoft и ее клиентами. В сфере фармацевтики к таковым относятся электронные документы FDA 21 CFR Part 11, электронные подписи (21 CFR Part 11) и EudraLex Volume 4 – Компьютеризированные системы (Приложение 11).
Используя облачные технологии для компьютеризированных систем GxP, пользователи должны оценить адекватность процессов и средств поставщика облачных услуг для обеспечения конфиденциальности, целостности и доступности данных, хранящихся в облаке.
Решение Microsoft Azure соответствует этим критериям на разных уровнях технологий безопасности и управления, операционных методов и политик соответствий, но при условии плодотворной совместной работы производителей лекарственных средств с компанией Microsoft.
Читайте статью на страницах журнала "Фармацевтическая отрасль" № 3 (68), июнь 2018 г.
26.06.2018





